Die Aerostatik handelt von Gasen insbesondere von den Gleichgewichtszuständen ruhender Gase. Darunter fällt auch die Atmosphäre und das darin enthaltene Gas, die Luft. Obwohl die Luft ein Gasgemisch ist (78% N2, 21% O2 und 1% Ar) behandeln wir dieses Gemisch, wie wenn es ein Monogasgemisch ist, also ein Gas, welches nur aus einem Element besteht. Hier werden folgende Themen behandelt:
- Zustandsänderungen von Gasen
- Universelle Gasgleichung
- Die Atmosphäre (Barometrische Höhenformel)
- Auftrieb in Gasen
Zustandsänderungen von Gasen
Im Unterschied zu Festkörper oder Flüssigkeiten, reagieren Gase sehr schnell auf kleinste Änderungen von Grössen, die seinen Zustand beschreiben. Dazu gehören Druck ![]() , Volumen
, Volumen ![]() und die Temperatur
und die Temperatur ![]() . Verändert sich eine dieser Grössen, so ändern sich immer auch die anderen Grössen. Es gibt jedoch auch bestimmte Fälle in denen ich eine Grösse festhalten kann, so dass sie sich nicht ändern kann. Dann ändern nur die zwei anderen Grössen. Zum Beispiel kann ich das Volumen festhalten, weil das Gas in einem Gefäss eingeschlossen ist und dieses Gefäss ändert die Grösse respektive das Volumen nicht. Wenn ich jetzt die Temperatur des Gefässes und damit des Gases ändere, so wird sich der Druck im Gefäss ändern. Ein solcher Prozess wird isochor genannt (isochor = Volumen bleibt gleich). Ändert hingegen die Temperatur nicht, so ist der Prozess isotherm und beim Festhalten des Drucks handelt es sich um einen isobaren Prozess:
. Verändert sich eine dieser Grössen, so ändern sich immer auch die anderen Grössen. Es gibt jedoch auch bestimmte Fälle in denen ich eine Grösse festhalten kann, so dass sie sich nicht ändern kann. Dann ändern nur die zwei anderen Grössen. Zum Beispiel kann ich das Volumen festhalten, weil das Gas in einem Gefäss eingeschlossen ist und dieses Gefäss ändert die Grösse respektive das Volumen nicht. Wenn ich jetzt die Temperatur des Gefässes und damit des Gases ändere, so wird sich der Druck im Gefäss ändern. Ein solcher Prozess wird isochor genannt (isochor = Volumen bleibt gleich). Ändert hingegen die Temperatur nicht, so ist der Prozess isotherm und beim Festhalten des Drucks handelt es sich um einen isobaren Prozess:
- Isochorer Prozess -> Volumen bleibt gleich
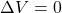 : Gesetz von Amontons
: Gesetz von Amontons - Isothermischer Prozess -> Temperatur ändert nicht
 : Gesetz von Boyle-Mariotte
: Gesetz von Boyle-Mariotte - Isobarer Prozess -> Druck ändert nicht
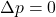 : Gesetz von Gay-Lussac
: Gesetz von Gay-Lussac
Isochorer Prozess:
Bei diesem Prozess ändert das Volumen nicht und der Druck und die Temperatur folgen dem Gesetz von Amontons:
![]()
Isothermer Prozess:
Bei diesem Prozess ändert die Temperatur nicht und der Druck und das Volumen folgen dem Gesetz von Boyle-Mariotte:
![]()
Isobarer Prozess:
Bei diesem Prozess ändert der Druck nicht und das Volumen und die Temperatur folgen dem Gesetz von Gay-Lussac:
![]()
Wie die drei Gesetze untereinander zusammen hängen, wird im nächsten Kapitel ausführlich aufgezeigt.
Universelle Gasgleichung
Die drei Prozesse aus dem letzten Abschnitt stellen alles Spezialfälle der universellen Gasgleichung dar. Wird keine der Zustandsgrössen eines Gases festgehalten, so ändern stets alle Grössen, wenn eine Grösse ändert. Also wenn z.B. die Temperatur ändert, dann ändert sowohl der Druck als auch das Volumen. Oder anders ausgedrückt gibt es zu zwei vorgegebenen Grössen nur eine mögliche Dritte Grösse, die die Gasgleichung erfüllt:
![]()
Die Grössen mit Index 1 bezeichnen einen ersten Zustand und die Grössen mit Index 2 einen zweiten Zustand. Genau genommen ist die Formel oben eine Vereinfachung der allgemeinen Zustandsgleichung eines Gases, so wie sie auch in der Chemie gebraucht wird:
![]()
In unserer Physik soll die Zahl der Teilchen nicht ändern, was bedeutet, dass ![]() konstant bleibt. Wird die Gleichung noch durch
konstant bleibt. Wird die Gleichung noch durch ![]() geteilt, dann landen wir bei der vereinfachten Gasgleichung, wie sie weiter oben beschrieben ist. Wie geht das genau?
geteilt, dann landen wir bei der vereinfachten Gasgleichung, wie sie weiter oben beschrieben ist. Wie geht das genau?
Aufgabe A1: Wie kommt man von der allgemeinen Gasgleichung auf unsere vereinfachte Darstellung des Gasgesetzes?
Die Atmosphäre
Die Abnahme des Drucks mit zunehmender Höhe kann näherungsweise mit der Barometrischen Höhenformel berechnet werden. Diese Formel berücksichtigt den exponentiellen Abfall des Drucks, wenn die Höhe zunimmt:
![]()
Der negative Exponent steht für eine Abnahme des Drucks mit zunehmender Höhe ![]() . Im Zähler des Exponenten erkennen wir den Schweredruck ausgehend von einer Höhe
. Im Zähler des Exponenten erkennen wir den Schweredruck ausgehend von einer Höhe ![]() . Die Dichte
. Die Dichte ![]() ist die Luftdichte auf Meereshöhe bei 15° (
ist die Luftdichte auf Meereshöhe bei 15° (![]() ). Der Schweredruck steht im Verhältnis zum Normaldruck
). Der Schweredruck steht im Verhältnis zum Normaldruck ![]() auf Meereshöhe. Die Exponentialfunktion liefert einen Wert, der kleiner als 1 ist und dieser Wert wird mit dem Normaldruck multipliziert.
auf Meereshöhe. Die Exponentialfunktion liefert einen Wert, der kleiner als 1 ist und dieser Wert wird mit dem Normaldruck multipliziert.
Umgekehrt kann bei einem gegebenen Druck ![]() berechnet werden, in welcher Höhe sich dieser Druck in der Atmosphäre befindet:
berechnet werden, in welcher Höhe sich dieser Druck in der Atmosphäre befindet:
![]()
Beachten Sie ganz genau den Unterschied zwischen der Dichte ![]() und dem Druck
und dem Druck ![]() . Die beiden Buchstaben ähneln sich und daher kann man sie oft nur schlecht unterscheiden!
. Die beiden Buchstaben ähneln sich und daher kann man sie oft nur schlecht unterscheiden!
Auftrieb in Gasen
Der Auftrieb in Gasen wird grundsätzlich ganz genau gleich berechnet, wie der Auftrieb in einer Flüssigkeit. Jedoch gibt es zwei grosse Unterschiede zwischen dem Auftrieb in Flüssigkeiten und dem Auftrieb in Gasen. Die Dichte von Gasen ist gegenüber Flüssigkeiten 800 – 1000 mal kleiner und Gase sind komprimierbar, Flüssigkeiten dagegen nicht. Der erste Unterschied hat zur Folge, dass ein Schwimmen auf Gasen nur sehr schwer möglich ist und der zweite Unterschied, dass die Dichte von Gas mit zunehmender Höhe abnimmt und zwar, wie wir weiter oben gesehen haben, nicht linear sondern exponentiell.
Typische Beispiele für Auftrieb in Gasen sind Ballonfahrten.